一、选择题(本题包括14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产和生活、军事、科研产品紧密相关,下列说法错误的是( )
A.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故
B.在牙膏中添入Na2PO3F、NaF能防治龋齿,当提供的氟离子浓度相等时,它们防治龋齿的作用是相同的
C.侯氏制碱法的工艺过程中主要应用了物质熔、沸点的差异
D.可用蘸浓盐酸的玻璃棒检验输送氨气的管道是否漏气
答案 C
解析 A项,次氯酸钠有强氧化性,盐酸有还原性,两者相遇发生氧化还原反应生成氯气,氯气有毒,正确;B项,防治龋齿的有效成分是氟离子,当氟离子浓度相等时,防治龋齿的作用是相同的,正确;C项,侯氏制碱法的工艺过程中主要应用了物质的溶解度的差异,错误;D项,浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,冒白烟,正确。
2.下列有关物质的分类与性质的说法正确的是( )

3.设阿伏加德罗常数的值为NA,下列叙述正确的是( )
A.3.1 g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA
B.0.1 mol Br中含有的中子数为3.5NA
C.标准状况下,11.2 L CHCl3中含有的C—Cl键的数目为1.5NA
D.0.5 L 1.0 mol·L-1 NH4Al(SO4)2溶液中含有的NH数目为0.5NA
 4.(2018·开封质检)下列关于有机物结构、性质的分析正确的是( )
4.(2018·开封质检)下列关于有机物结构、性质的分析正确的是( )
A.正丁烷和异丁烷的一氯取代物都只有两种,它们的沸点也相同
B.乙烯分子与苯分子都能与H2发生加成反应,说明二者均含碳碳双键
C.甲烷、苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
D.乙醛加入Cu(OH)2粉末并加热可看到红色沉淀生成
答案 C
解析 A项,正丁烷和异丁烷是两种不同的物质,正丁烷的一氯代物沸点与异丁烷的一氯代物沸点不同,错误;B项,苯中不含碳碳双键和碳碳单键,但苯能发生加成反应,错误;C项,在一定条件下,烷烃、苯及其同系物、醇、羧酸和酯类都能发生取代反应,注意酯类的水解反应属于取代反应,正确;D项,乙醛与新制Cu(OH)2悬浊液加热煮沸可看到红色沉淀生成,不是Cu(OH)2粉末,错误。
5.下列关于有机化合物的说法正确的是( )
A.淀粉、油脂和蛋白质都是高分子化合物

C.乙烯和聚乙烯都能使溴水褪色
 6.下列化学实验事实及其解释都正确的是( )
6.下列化学实验事实及其解释都正确的是( )
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol·L-1稀硫酸,铜屑又逐渐溶解是因为铜可直接与1 mol·L-1稀硫酸反应
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.工业制玻璃的主要反应之一:Na2CO3+SiO2Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
答案 C
解析 A项,在酸性条件下,NO可继续氧化铜;B项,是因为发生原电池反应;D项,是用难挥发性物质制取易挥发性物质。
7.下列实验能达到实验目的而且符合实验设计要求的是( )
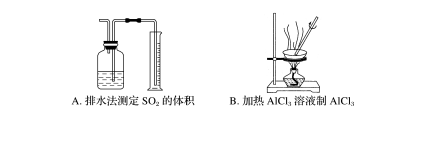
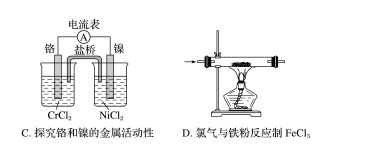
答案 C
解析 SO2能溶于水且与水反应,不能用排水法测定其体积,A错误;加热AlCl3溶液时,氯化铝在水中会发生水解,最终得不到AlCl3,B错误;根据电流表指针偏转方向可以判断镍和铬的金属活动性强弱,C正确;氯气有毒,题图没有尾气回收或处理装置,D错误。
8.已知H2O2是一种弱酸性物质,在强碱溶液中主要以HO形式存在。现以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是( )
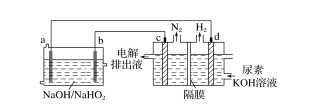
A.a电极的电极反应式为:HO+2e-+H2O===3OH-
B.反应过程中,电子的流向为:d→a,b→c
C.电解消耗2.7 g Al时,产生N2的体积为1.12 L
D.电解过程中,燃料电池中溶液的pH不断减小
答案 D
解析 根据电解池中c极上发生氧化反应生成N2知,c极为阳极,故d极为阴极,所以a极是负极,b极为正极,a极的电极反应式为Al-3e-+4OH-===AlO+2H2O,A错误;a极为负极,b极为正极,c极为阳极,d极为阴极,故反应过程中电子的流向为a→d,c→b,B错误;根据各电极上转移的电子数相等知,每消耗0.1 mol Al,转移0.3 mol电子,生成0.05 mol N2,在标准状况下N2的体积为1.12 L,但题中未标明标准状况,C错误;Al—H2O2燃料电池的总反应为:2Al+9H2O2+8OH-===2AlO+6HO+10H2O,反应中有OH-消耗,溶液的pH减小,D正确。
9.W、X、Y、Z为原子序数依次增大的短周期元素。已知W的某种单质是自然界中硬度最大的物质,a为W的最高价氧化物,Y是地壳中含量最高的金属元素,b、c、d分别为X、Y、Z的最高价氧化物对应的水化物。化合物a~g的转化关系如图所示(部分产物已略去)。下列说法正确的是( )
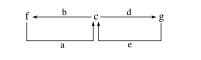
A.简单离子半径大小:X>Y>Z
B.a中含有极性共价键,属于共价化合物
C.g的水溶液可显中性
D.工业上通过电解其氯化物的方法制取Y的单质
答案 B
解析 由W的某种单质是自然界中硬度最大的物质,可知W为碳元素,a为CO2,由Y是地壳中含量最高的金属元素,可知Y是铝元素,c是Al(OH)3,由转化关系知b、d为强酸或强碱,且f能与CO2反应生成Al(OH)3,则b只能为强碱,又X位于C与Al之间,故X为钠元素,b为NaOH,f为NaAlO2,结合原子序数关系知,d只能为强酸,且符合题意的有H2SO4和HClO4,所以Z为S或Cl,g为Al2(SO4)3或Al(ClO4)3。A项,简单离子半径大小:S2-(或Cl-)>Na+>Al3+,错误;B项,CO2中的共价键为不同种元素间形成的极性共价键,CO2为共价化合物,正确;C项,g溶液中Al3+水解使溶液显酸性,错误;D项,工业制铝利用的是电解熔融状态的氧化铝,错误。
10.硬水中含有浓度较大的Ca(HCO3)2、Mg(HCO3)2,水垢的主要成分是CaCO3和Mg(OH)2,而不是Ca(OH)2和MgCO3,下列解释最合理的是( )
A.浓度:c(Ca2+)>c(Mg2+)
B.碱性:Ca(OH)2>Mg(OH)2
C.溶解度:CaCO3>Ca(OH)2
D.溶解度:MgCO3>Mg(OH)2
答案 D
解析 HCO在水中存在两个平衡:①电离平衡HCOH++CO,②水解平衡HCO+H2O===H2CO3+OH-,Ca2+、Mg2+分别与CO、OH-结合生成相应物质。由于碳酸钙难溶于水,氢氧化钙微溶于水,根据离子反应总是向着离子浓度减小的方向进行,产物的溶解度越小,反应越容易发生,即碳酸氢钙在水中受热,生成碳酸钙沉淀的反应为主要反应,水解生成氢氧化钙的反应为次要反应。同理,由于氢氧化镁的溶解度小于碳酸镁,对于碳酸氢镁溶液,受热时生成氢氧化镁的反应为主要反应,生成碳酸镁的反应为次要反应。所以D项符合题意。
11.(2019·长沙模拟)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2 g、12.9 g和1.3 g。
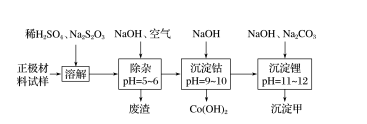
下列说法正确的是( )
A.沉淀甲是LiOH
B.在上述溶解过程,Na2S2O3、LiCoO2反应的化学方程式为8LiCoO2+Na2S2O3+11H2SO4===4Li2SO4+8CoSO4+Na2SO4+11H2O
C.已知:常温下Ksp[Co(OH)2]=1.58×10-15。沉淀钴过程中,当溶液pH=10时,溶液中c(Co2+)=1.58×10-11 mol·L-1
D.分离沉淀所需要的玻璃仪器主要是分液漏斗
 12.为研究加热条件下某铁钉(碳素钢)与一定量的浓硫酸反应生成气体Y的成分,某学习小组设计了下列实验装置(图中加热及夹持仪器省略)。下列说法不正确的是( )
12.为研究加热条件下某铁钉(碳素钢)与一定量的浓硫酸反应生成气体Y的成分,某学习小组设计了下列实验装置(图中加热及夹持仪器省略)。下列说法不正确的是( )
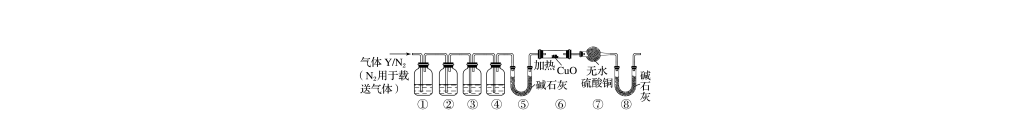
A.①②③中可依次盛放品红溶液、NaOH溶液、澄清石灰水
B.装置⑧可以换成盛有浓硫酸的洗气瓶
C.气体Y的成分可能有3种
D.在加热装置⑥之前,必须收集⑧处排出的气体并点燃,检验气体的纯度
答案 A
解析 碳素钢暗示反应产生的气体中会有SO2和CO2,一定量的浓硫酸暗示随着反应的进行,硫酸的浓度会逐渐变小,稀硫酸可与Fe反应产生H2,所以气体Y的成分可能有SO2、CO2和H2三种气体,C项正确;由于SO2的存在会对CO2的检验(利用澄清石灰水检验)产生干扰,所以必须先检验SO2,并且保证SO2除干净后才能检验CO2,故①②③④中的试剂分别为品红溶液、酸性KMnO4溶液(或溴水)、品红溶液、澄清石灰水,NaOH溶液能吸收CO2,故A项错误;⑧中碱石灰可防止空气中的水蒸气进入⑦中,干扰H2的检验,若换成盛有浓硫酸的洗气瓶,则可以起到相同的作用,B项正确;加热或点燃H2前,必须检验其纯度,防止爆炸,D项正确。
13.(2019·南宁调研)X、Y、Z、W是原子序数依次递增的短周期元素,已知X元素能组成自然界中最坚硬的单质,X与W同主族,Y2-和Z2+具有相同的电子层结构。下列说法不正确的是( )
A.Z2+能促进水的电离
B.常见单质的熔点:X>Z>Y
C.离子半径大小:Y2-<Z2+
D.Y与W组成的二元化合物是制耐高温坩埚的常用材料
答案 C
解析 依题意可知X是碳、Y是氧、Z是镁、W是硅。Mg2+能促进水的电离,A正确;单质的熔点:石墨>金刚石>晶体硅>镁>氧气,B正确;离子半径:Y2->Z2+,C错误;二氧化硅熔点高,用于制石英坩埚,D正确。
14.25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10 mL 0.10 mol·L-1 NaOH溶液中,lg 与pH的关系如图所示,C点坐标是(6,1.7)。下列说法不正确的是( )
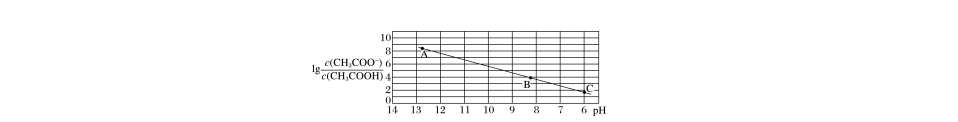
A.pH=7时加入的醋酸溶液的体积大于10 mL
B.C点后继续加入醋酸溶液,水的电离程度减小
C.B点存在c(Na+)-c(CH3COO-)=(10-6-10-8) mol·L-1
D.Ka(CH3COOH)=5.0×10-5
答案 C
解析 当往10 mL 0.10 mol·L-1 NaOH溶液中加入10 mL 0.10 mol·L-1醋酸溶液时,得到CH3COONa溶液,溶液呈碱性,故当pH=7时加入的醋酸溶液体积应大于10 mL,A正确;C点pH=6,C点后继续加入醋酸溶液,溶液pH减小,说明CH3COOH的浓度增大,对水的电离的抑制程度增大,水的电离程度减小,B正确;
Ka(CH3COOH)=,
lg Ka(CH3COOH)=lg -pH,将C点坐标(6,1.7)代入可得,lg Ka(CH3COOH)=1.7-6=-4.3,Ka(CH3COOH)≈5.0×10-5,D正确;B点时,将lg =4代入lg Ka(CH3COOH)=lg -pH=-4.3得,pH=8.3,c(H+)=10-8.3 mol·L-1,结合电荷守恒式:c(CH3COO-)+c(OH-)=c(H+)+c(Na+)知,c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=(10-5.7-10-8.3) mol·L-1,C错误。
二、非选择题(本题包括5小题,共58分)
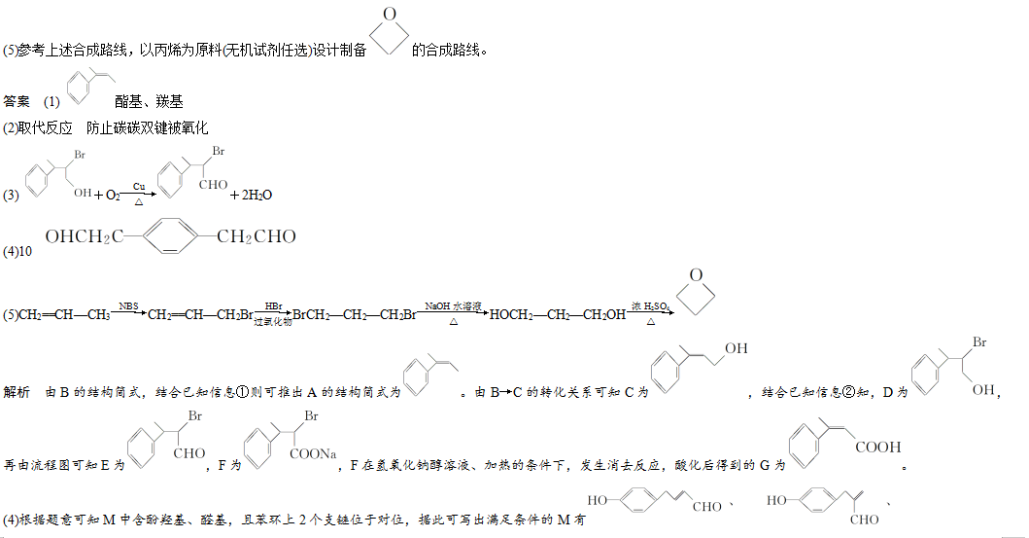
15.(11分) (2018·潍坊市上学期期中)环境问题越来越受到人们的重视,研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
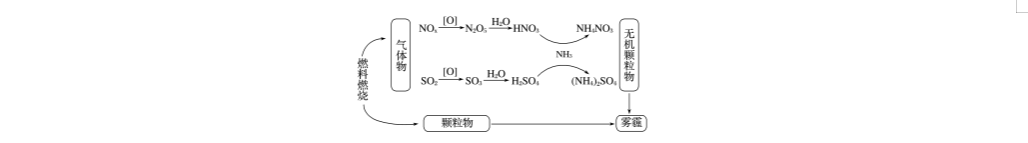
回答下列问题:
(1)NH3的电子式为________________,NH4NO3中含有的化学键是________________。
(2)下列关于雾霾的叙述错误的是________(填字母)。
A.雾霾中含有硝酸铵和硫酸铵
B.NH3是形成无机颗粒物的催化剂
C.雾霾的形成与过度施用氮肥有关
D.雾霾的形成过程涉及氧化还原反应
(3)预防含硫化合物雾霾生成的方法之一是将氨气和二氧化硫通入水中,再充入O2充分反应生成一种正盐,该反应的化学方程式为________________________________________
________________________________________________________________________。
预防含氮化合物雾霾生成的方法之一是用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,电解后该溶液的pH________(填“变大”“变小”或“不变”)。
(4)在有氧条件下,催化剂能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx混合气体匀速通入装有催化剂的反应器中反应,测得反应温度高于380 ℃时,NOx的去除率迅速下降,其原因之一是催化剂活性下降,另一重要原因是__________________。
在无氧条件下,反应器中NH3能将NO2还原为N2,当生成1 mol N2时转移电子________mol(可用分数表示)。
 (3)2SO2+4NH3+2H2O+O2===2(NH4)2SO4 变小
(3)2SO2+4NH3+2H2O+O2===2(NH4)2SO4 变小
(4)NH3与O2反应生成了NO
16.(10分)(2018·吉林联考)二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上以CO和H2为原料生产二甲醚(CH3OCH3)的新工艺主要发生以下三个反应:
①CO(g)+2H2(g)CH3OH(g)
ΔH1=-Q1 kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g)
ΔH2=-Q2 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g)
ΔH3=-Q3 kJ·mol-1
回答下列问题:
(1)新工艺的总反应3H2+3COCH3OCH3+CO2的热化学方程式为__________________________________________________________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH
下表所列数据是该反应在不同温度下的化学平衡常数(K):
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH________(填“>”“=”或“<”)0。能够说明某温度下该反应达到平衡状态的是________(填字母)。
A.体系的压强不变
B.密度不变
C.混合气体的平均相对分子质量不变
D.c(CO)=c(CH3OH)
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应10 min后,达到平衡时测得c(CO)=0.2 mol·L-1,计算此温度下的平衡常数K=________________________。
(3)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨的反应原理为N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,在恒容密闭容器中充入一定量N2和H2后,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
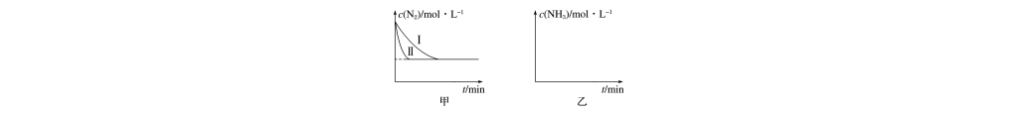 请回答下列问题:
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为____________________________________________。
②在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。
答案 (1)3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)
ΔH=-(2Q1+Q2+Q3) kJ·mol-1

解析 (1)根据总反应各物质的关系可知:总反应式=①×2+②+③,ΔH=(-Q1)×2+(-Q2)+(-Q3)。
(2)①根据表中数据可知温度升高,平衡常数K减小,平衡向逆反应方向移动,则正反应为放热反应;A项,这是一个气体分子数改变的反应,压强不变说明气体分子数不变,反应达到平衡;B项,密度等于质量除以体积,由于该反应是纯气体反应,而容器体积固定,故密度一直不变;C项,混合气体平均相对分子质量等于质量除以总物质的量,由于分子数改变,只要没有达到平衡,气体的平均相对分子质量一定改变,故气体的平均相对分子质量不变,则体系一定达到平衡;D项,两者浓度相等,不一定达到平衡。②达到平衡时测得c(CO)=0.2 mol·L-1,则转化的CO的物质的量为2.0 mol-0.2 mol·L-1×2 L=1.6 mol,所以CO的转化率为×100%=80%,则
CO(g)+2H2(g)CH3OH(g)
转化量/mol·L-1 0.8 1.6 0.8
平衡量/mol·L-1 0.2 1.4 0.8
所以K=≈2.041。(3)①实验Ⅱ与实验Ⅰ平衡状态相同,而实验Ⅱ达到平衡所需时间短,所以实验Ⅱ使用的条件只能是加催化剂。②由于正反应是放热反应,所以升高温度反应速率增大,达到平衡的时间减少,但生成氨气的浓度降低,不难画出正确图形。
17.(10分)某化学小组拟设计实验探究SO2与钙盐溶液的反应情况。
【文献资料】
①CaSO3是难溶于水、易溶于盐酸的白色固体;
②实验室用Na2SO3粉末和80%硫酸反应制备SO2;
③浓硫酸与水混合时放出大量的热,产生大量“酸雾”。
【设计实验】
实验Ⅰ:探究二氧化硫与氯化钙溶液反应。
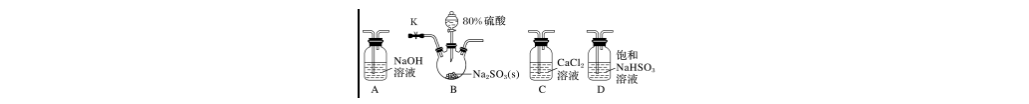
(1)若气体从左至右流动,选择装置并排序为________(填代号)。
(2)D装置作用是___________________________________________
(用离子方程式表示)。
(3)连接装置进行实验,发现C装置中产生白色沉淀。
①甲同学对白色沉淀成分提出如下假设:
假设1:白色固体是CaSO3;
假设2:白色固体是CaSO4;
假设3:白色固体是CaSO4和CaSO3。
②乙同学设计实验证明白色沉淀是CaSO4,他的实验方案是_____________________________
________________________________________________________________________。
③丙同学认为C中生成硫酸钙的原因是装置内O2氧化了SO2。
排除装置内O2干扰采取的措施是:在启动B中反应之前,____________(填实验步骤)
重新实验,C中无明显现象,所以SO2和CaCl2溶液不反应。
实验Ⅱ:探究SO2和Ca(ClO)2溶液反应。
丁同学仅将上述实验C装置中氯化钙溶液换成漂白精溶液,进行实验时产生了大量白色沉淀。
(4)化学反应有两种情况。
①若SO2过量,则发生反应为Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4
②若SO2少量,则发生反应为____________________________________________________
________________________________________________________________________。
(5)为了探究C中SO2是否过量,戊同学取少量C中上层清液于试管中,加入下列物质可以达到实验目的的是________(填字母)。
a.NaHCO3溶液 b.品红溶液
c.AgNO3溶液 d.紫色石蕊溶液
答案 (1)BDCA
(2)HSO+H+===SO2↑+H2O
(3)②取少量白色固体于试管,加入盐酸,白色固体不溶解
③打开K,通入一定时间N2(或Ar)
(4)Ca(ClO)2+SO2+H2O===CaSO4↓+HClO+HCl
(5)bd
解析 (1)阅读文献知,浓硫酸与亚硫酸钠反应时会形成酸雾,酸雾中含有硫酸,所以SO2中混有硫酸,如果不净化SO2,硫酸与氯化钙反应产生硫酸钙。实验装置顺序:制备SO2、除去SO2中酸雾、SO2与氯化钙溶液反应、吸收尾气等。
(2)类似除去CO2气体中氯化氢,用饱和亚硫酸氢钠溶液除去SO2中的“酸雾”,化学方程式为2NaHSO3+H2SO4===Na2SO4+2SO2↑+2H2O。
(3)②利用硫酸钙不溶于盐酸,亚硫酸钙溶于盐酸。不能选择硝酸与白色沉淀反应,因为3CaSO3+2HNO3===3CaSO4↓+2NO↑+H2O。③空气中氧气干扰,其过程为SO2+H2O===H2SO3,2H2SO3+O2===2H2SO4,CaCl2+H2SO4===CaSO4↓+2HCl。装置B中还有导管未用,可以打开K,向装置内通入N2(或Ar)等惰性气体,将装置内空气排出来,避免干扰。
(4)观察、分析SO2过量、少量的产物不完全相同。如果SO2少量,部分次氯酸没有被还原,即产物有次氯酸。
(5)将问题转化成“检验次氯酸、硫酸”,利用次氯酸具有漂白性,用品红溶液、紫色石蕊溶液检验。
18.(12分)Ni2O3在工业上有重要的应用。以镍粉废料为原料提取Ni2O3的工艺流程如图所示。
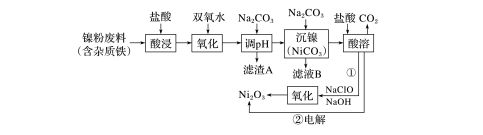
请回答下列问题:
(1)加入双氧水“氧化”的离子方程式为_______________________________________
________________________________________________________________________;
滤渣A的主要成分是____________(填化学式)。
(2)方法①中为了控制“氧化”效率,加入NaOH与NaClO的最佳物质的量之比=________。
(3)方法②用电解法制取Ni2O3时,先用NaOH调节酸溶后的溶液的pH至7.5,再加入适量Na2SO4用惰性电极进行电解。电解过程中所产生的Cl2大约有40%在弱碱性条件下生成ClO-,ClO-再把二价镍氧化为三价镍。加入Na2SO4的作用是__________________;
当有n mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为____________。
(4)工业上,镍作阳极,电解0.1 mol·L-1 NiCl2溶液与一定量NH4Cl溶液组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl溶液的浓度对阴极电流效率(电极上实际沉积的物质的量与理论析出量之比)及Ni的成粉效率的影响如图所示。
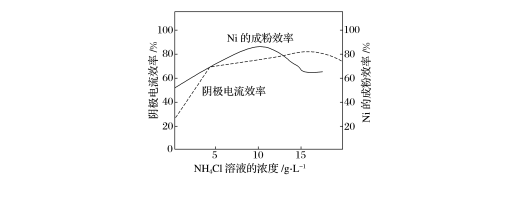
①为获得高纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为________g·L-1。
②当NH4Cl溶液的浓度大于15 g·L-1时,阴极有气体生成,导致阴极电流效率降低,请结合平衡移动原理解释其原因:____________________________________________
________________________________________________________________________。
答案 (1)2Fe2++2H++H2O2===2Fe3++2H2O Fe(OH)3 (2)4∶1
(3)增强溶液的导电性 2.5n mol
(4)①10 ②随着NH4Cl溶液浓度增大,NH+H2ONH3·H2O+H+水解平衡向右移动,H+浓度增大,导致阴极放出氢气
解析 (1)双氧水可将亚铁离子氧化;加入Na2CO3调节pH可使铁离子生成Fe(OH)3沉淀。(2)步骤①中,次氯酸钠将Ni2+氧化为Ni2O3,离子方程式为2Ni2++ClO-+4OH-===Ni2O3↓+2H2O+Cl-,故加入NaOH与NaClO的最佳物质的量之比为4∶1。(3)电解产生的Cl2大约有40%在弱碱性条件下生成ClO-,ClO-再把二价镍氧化为三价镍,则有关系式:ClO-~2Ni2+。当有n mol二价镍全部转化为三价镍时,参加反应的ClO-的物质的量为0.5n mol,则电解生成的n(Cl2)=1.25n mol,电解时阳极的电极反应式为2Cl--2e-===Cl2↑,则转移的电子的物质的量n(e-)=2.5n mol。(4)①为获得高纯度的球形超细镍粉,由题图可看出NH4Cl溶液的浓度最好控制为10 g·L-1。②NH4Cl溶液的浓度大于15 g·L-1时,随着NH4Cl溶液浓度的增大,NH+H2ONH3·H2O+H+水解平衡向右移动,H+浓度增大,导致阴极放出氢气,阴极上生成Ni的量降低,从而导致阴极电流效率降低。
19.(15分)选做题(从下面Ⅰ、Ⅱ两小题中任选一题做答)
Ⅰ.[化学——选修3:物质结构与性质]
据中国之声《央广新闻》报道,河南发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,还发现大量天然碱、铅锌矿产资源。
根据上述信息,回答下列问题:
(1)在元素周期表中,铅与锗同主族,铅的周期数比锗大2。基态铅原子的价层电子排布式为____________,有________个未成对电子。
(2)镓与锌同周期,原子序数比锌大1,锌的第一电离能大于镓的第一电离能,其原因是________________________________________________________________________
________________________________________________________________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
①天然碱的晶体类型是____________;存在的作用力类型主要有_________________________________。
②CO的立体构型是____________;H2O中O原子采取________杂化。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]-+Zn===2Au+[Zn(CN)4]2-。
①与CN-互为等电子体的离子有________(任写一种);HCN分子中σ键和π键数目之比为________。
②[Zn(CN)4]2-的配体是________。
(5)金的晶胞如图所示。已知:金晶体的密度为ρ g·cm-3,M(Au)=197 g·mol-1。
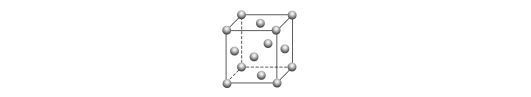
①金原子的配位数为________。
②金原子(或粒子)的半径r=________pm(用代数式表示)。
③金晶胞中原子空间利用率φ(原子总体积与晶胞体积之比)为________。
答案 (1)6s26p2 2
(2)基态锌原子的价层电子达到全充满的稳定结构
(3)①离子晶体 离子键、共价键、氢键 ②平面三角形 sp3
(4)①C(或O) 1∶1 ②CN-
 Ⅱ.[化学——选修5:有机化学基础]
Ⅱ.[化学——选修5:有机化学基础]
某合成药物的中间体H的合成路线如下:
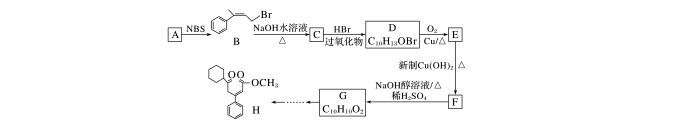
已知:①R—CH==CH—CH3R—CH==CH—CH2—Br
②RCH===CH2+HBrRCH2CH2Br
回答下列问题:
(1)A的结构简式为________________。H中含有的含氧官能团名称是________________。
(2)A→B的反应类型为______________,设计C→D的目的为__________________________。
(3)D→E的化学方程式为__________________________________________________。
(4)M和N均与G互为同分异构体。M中含有苯环,苯环上有2个支链,且苯环上的一氯代物只有2种,M遇FeCl3溶液显紫色,能与新制Cu(OH)2悬浊液反应生成砖红色沉淀,则满足条件的M有________种(不考虑顺反异构)。N为芳香族化合物,0.5 mol N与足量银氨溶液反应生成2 mol Ag,核磁共振氢谱显示其峰面积之比为1∶2∶2,则N的结构简式为________________________________________________________________________。